137-1288-2333
全国咨询热线
400-030-2118近日, 美国食品和药物管理局(FDA)对来自中国的塑料注射器进口加强了监管,并计划在必要时阻止中国制造的注射器进入美国。原因是担心其质量问题可能影响医疗安全。
在去年11月收到了几家中国注射器制造商的质量问题报告后,FDA首次建议消费者,医护人员和医疗机构,“如果可能,考虑使用非中国制造的注射器”。
随后分别对江苏神力医疗产品有限公司、江苏彩纳医疗器械有限公司、浙江龙德医药有限公司和上海康德莱企业发展集团有限公司等多家中国制造商发布进口禁令。
截止2024年5月14日,采纳和神力分别有190批和47批产品被拒绝入境,康德莱和龙德暂无拒绝入境记录。
据共研网统计2017-2022年期间,我国一次性注射器年出口数量从138.68亿个增加到202.89亿个。
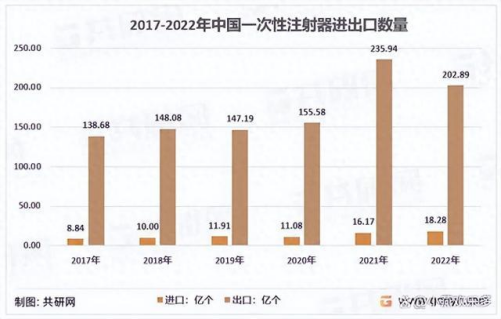
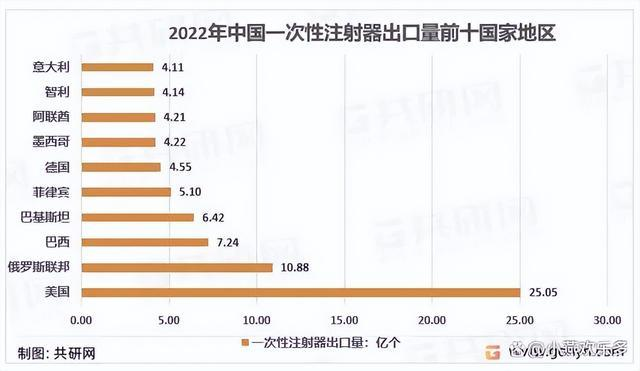
我国共向191个国家和地区出口一次性注射器,其中美国是压倒性的海外第一大市场,22年向美国的出口量达到了25.05亿个。
注射器事件始末
纵观历史,这还是FDA首次,对中国某个领域的所有制造商“开枪”。
而整件事情的起因,还要从2023年11月说起。彼时,FDA发布安全通知称,收到了有关几家中国注射器制造商的质量问题的信息,建议当地机构避开中国制造的塑料注射器。
2023年12月开始,FDA检查员走访在美国销售分销中国注射器的多家企业。其中包括Medline Industries和Sol-Millennium Medical的工厂。调查发现,这两家企业不仅进口和销售未经批准的中国制造的塑料注射器, 同时还有违反质量体系规定的行为。
今年3月18日,FDA就销售和分销未经批准的相关违规行为,向江苏神力医疗、Medline Industries和Sol-Millennium Medical发出警告信。
根据信件内容,江苏神力仅获得了5mL luer-lock活塞注射器的 510(k) 认证,但却向美国市场销售了3、10、20、50和60毫升鲁尔锁定注射器。
此外,FDA 在给Medline Industries公司的警告信中还提到了江苏采纳医疗科技公司生产的塑料注射器的质量问题和性能测试失败的问题。FDA 了解到,江苏采纳的几款塑料注射器的性能测试显示出现意外且无法解释的故障。
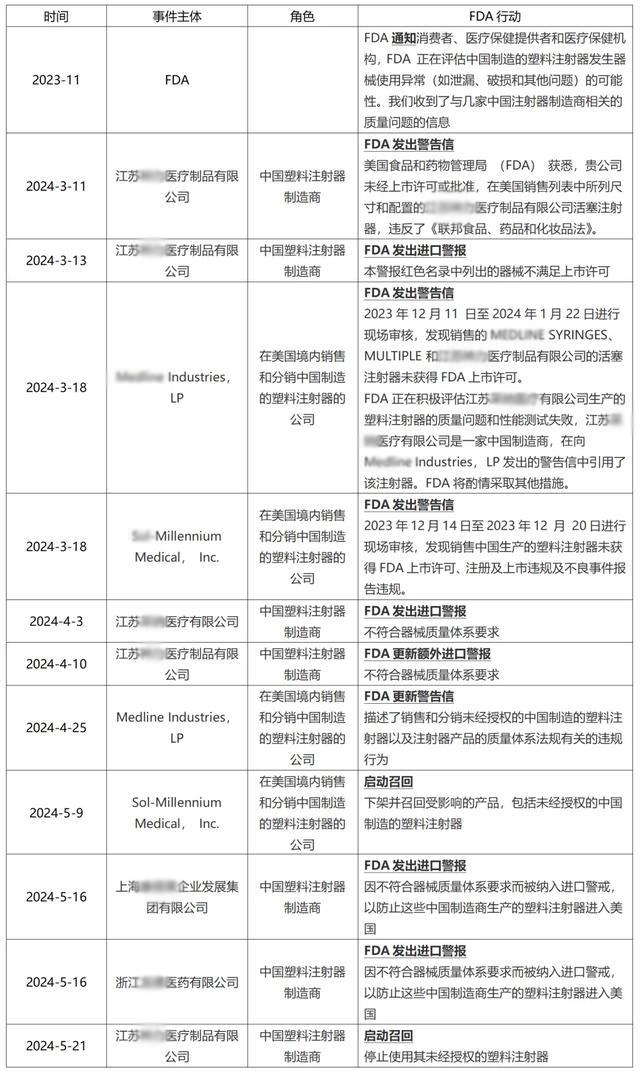
随后,FDA扩大对江苏神力的调查,并于4月向Cardinal发出警告。
据悉,Cardinal的手术包套组中涵盖从Merit Medical采购的塑料注射器,而该产品正是由江苏神力生产。Merit 在收到FDA的通知后,召回了这些套件。随后Cardinal也召回了受影响的手术包产品。
医疗行业针对产品质量、用料、甚至生产环境、生产设备容器、都有严格的规定很多可能某一方面不符合就导致整个产品不符合质量安全要求。
质量是企业生命,诚信是企业根本
宝星作为一家专注医疗行业特种润滑服务品牌商,协助客户将产品质量及使用安全放在首位,针对一次性医用耗材列如(医用注射器、输液器、医用导管)根据工况需求提供全方位润滑解决方案,有效解决医用场景的产品部件在使用时造成的:卡顿、油脂与材料产生化学反应、耐高低温、噪音异响、磨擦磨损、漏油甩油等造成产品使用体验及安全问题。针对上述注射器案例已具有高效安全的润滑解决方案,避免因某部件不符合医疗器械质量标准导致的不合格。宝星食品级医用润滑油符合FDA NSF食品级标准,通过生物相容性医用安全认证,是医用行业润滑剂的最佳选择。
